1.
PENGERTIAN
SISTEM KOLOID
Sistem
koloid adalah suatu bentuk campuran yang keadaannya terletak antara larutan dan
suspensi (campuran kasar). Sistem koloid ini mempunyai sifat-sifat khas yang
berbeda dari sifat larutan atau suspensi. Keadaan koloid bukan ciri dari zat
tertentu karena semua zat, baik padat, cair, maupun gas, dapat dibuat dalam
keadaan koloid.
Sistem
koloid sangat berkaitan erat dengan hidup dan kehidupan kita sehari-hari.Cairan
tubuh, seperti darah adalah sistem koloid, bahan makanan seperti susu, keju,
nasi, dan roti adalah sistem koloid. Cat,berbagai jenis obat, bahan kosmetik,
tanah pertanian juga merupakan sistem koloid. Karena sistem koloid sangat
berpengaruh bagi kehidupan sehari-hari, kita harus mempelajarinya lebih
mendalam agar kita dapat menggunakannya dengan benar dan dapat bermanfaat untuk
diri kita.
Sistem koloid
terdiri dari fase terdispersi dengan ukuran tertentu dalam medium
pendispersi.Zat yang didispersikan disebut fase terdispersi, sedangkan medium
yang digunakan untuk mendispersikan disebut medium pendispersi. Analogi dalam
larutan, fase terdispersi adalah zat terlarut sedangkan medium pendispersi
adalah zat pelarut. Contoh : campuran susu dan air, fase terdispersi adalah
partikel susu dan medium pendispersi adalah air
Sistem
koloid termasuk salah satu sistem dispersi. Sistem dispersi lainnya adalah larutan
dan suspensi. Larutan merupakan sistem dispersi yang ukuran partikelnya sangat
kecil, sehingga tidak dapat dibedakan antara partikel dispersi dan pendispersi.
Sedangkan suspensi merupakan sistem dispersi dengan partikel berukuran besar
dan tersebar merata dalam medium pendispersinya . Sistem Koloid adalah suatu
bentuk campuran yang keadaannya terletak antara larutan dan suspensi (campuran
kasar). Secara makroskopis koloid tampak homogen, tetapi secara mikroskopis
bersifat heterogen. Campuran koloid umumnya bersifat stabil dan tidak dapat
disaring. Ukuran partikel koloid terletak antara 1 nm-10 nm. Perbandingan sifat
larutan, koloid dan suspensi adalah sebagai berikut:
Tabel 1.1
Perbedaan larutan sejati, koloid, dan suspensi
|
No
|
Larutan sejati
|
Koloid
|
Suspensi
|
|
1
|
Diameter < 10-7cm
|
Diameter 10-7 cm – 10-5 cm
|
Diameter > 10-5 cm
|
|
2
|
Satu fase
|
Dua fase
|
Dua fase
|
|
3
|
Jernih
|
Agak keruh
|
Keruh
|
|
4
|
Homogen
|
Antara homogen dan heterogen
|
Heterogen
|
|
5
|
Tidak dapat disaring
|
Tidak dapat disaring
|
Dapat disaring
|
|
6
|
Tidak mengendap
|
Sukar mengendap
|
Mudah mengendap
|
|
7
|
Stabil
|
Relatif stabil
|
Tidak stabil
|
|
8
|
Amikron, dapat dilihat dengan mikroskop electron,
tetapi tidak dapat dilihat dengan mikroskop ultra
|
Submikron, dapat dilihat dengan mikroskop ultra,
tetapi tidak dapat dilihat dengan mikroskop biasa
|
Mikron, dapat dilihat dengan mikroskop biasa
|
2.
JENIS-JENIS
KOLOID
Telah kita ketahui bahwa sistem koloid terdiri atas
dua fasa, yaitu fasa terdispersi dan fasa pendispersi (medium dispersi). Sistem
koloid dapat dikelompokkan berdasarkan jenis fasa terdispersi dan fasa
pendispersinya. Koloid yang mengandung fasa terdispersi padat disebut sol.
Jadi, ada tiga jenis sol, yaitu sol padat (padat dalam padat), sol cair (padat
dalam cair), dan sol gas (padat dalam gas). Istilah sol biasa digunakan untuk
menyatakan sol cair, sedangkan sol gas lebih dikenal sebagai aerosol (aerosol
padat).
Koloid yang mengandung fasa terdispersi cair disebut
emulsi. Emulsi juga ada tiga jenis, yaitu emulsi padat (cair dalam padat),
emulsi cair (cair dalam cair), dan emulsi gas (cair dalam gas). Istilah emulsi
biasa digunakan untuk menyatakan emulsi cair, sedangkan emulsi gas juga dikenal
dengan nama aerosol (aerosol cair). Koloid yang mengandung fasa terdispersi gas
disebut buih. Hanya ada dua jenis buih, yaitu buih padat dan buih cair. Mengapa
tidak ada buih gas? Istilah buih biasa digunakan untuk menyatakan buih cair.
Dengan demikian ada 8 jenis koloid, seperti yangtercantum pada tabel 1.2.
|
No
|
Fase terdispersi
|
Medium pendispersi
|
Nama koloid
|
Contoh
|
|
1
|
Gas
|
Cair
|
Busa
|
Buih sabun, ombak, limun, krem kocok (whipped cream)
|
|
2
|
Gas
|
Padat
|
Busa padat
|
Batu apung, lava, karet busa, biscuit
|
|
3
|
Cair
|
Gas
|
Aerosol cair
|
Kabut, awan, hairspray, obat semprot
|
|
4
|
Cair
|
Cair
|
Emulsi
|
Susu, santan, minyak ikan
|
|
5
|
Cair
|
Padat
|
Gel
|
Keju, mentega, nasi, selai, lateks, agar-agar,
mutiara, semir padat, lem padat
|
|
6
|
Padat
|
Gas
|
Aerosol padat
|
Asap, debu, buangan knalpot
|
|
7
|
Padat
|
Cair
|
Sol
|
Kanji, cat, tinta, putih telur, lumpur, semir cair,
lem cair
|
|
8
|
Padat
|
Padat
|
Sol padat
|
Tanah, kaca, permata, perunggu, kuningan
|
a. Aerosol
Sistem
koloid dari partikel padat atau cair yang terdispersi dalam gas disebut
aerosol. Jika zat yang terdispersi berupa zat padat disebut aerosol padat, jika
zat yang terdispersi berupa zat cair disebut aerosol cair. Aerosol padat
contohnya: asap dan debu di udara, aerosol cair contohnya: kabut dan awan.
Dewasa ini
banyak produk dibuat dalam bentuk aerosol, seperti semprot rambut (hair spray),
semprot obat nyamuk, parfum, cat semprot, dan lain-lain. Untuk menghasilkan
aerosol diperlukan suatu bahan pendorong (propelan aerosol). Contoh bahan
pendorong yang banyak digunakan adalah senyawa klorofluorokarbon (CFC) dan
karbon dioksida.
b. Sol
Sistem koloid dari partikel padat
yang terdispersi dalam zat cair disebut sol. Koloid jenis sol banyak ditemui
dalam kehidupan sehari-hari contohnya: sol sabun, sol detergen, sol kanji,
tinta tulis, air sungai berlumpur dan cat.
c.
Emulsi
Sistem koloid dari zat cair yang terdispersi dalam zat cair disebut emulsi.
Syarat terjadinya emulsi ini adalah
kedua zat cair tidak saling melarutkan. Emulsi dapat digolongkan menjadi dua
bagian, yaitu emulsi minyak dalam air atau emulsi air dalam minyak. Contoh
emulsi minyak dalam air adalah santan, susu, dan lateks. Contoh emulsi air dalam
minyak adalah minyak ikan, minyak bumi.
Emulsi terbentuk karena adanya zat
pengemulsi (emulgator), contoh emulgator adalah sabun yang dapat mengemulsikan
minyak dalam air. Contoh emulgator lainnya adalah kasein dalam susu dan kuning
telur dalam mayonaise.
d.
Buih
Sistem koloid dari gas yang
terdispersi dalam zat cair disebut buih. Seperti halnya dengan emulsi, untuk
menstabilkan buih diperlukan zat pembuih, misalnya sabun, deterjen, dan
protein. Buih dapat dibuat dengan mengalirkan suatu gas ke dalam zat cair yang
mengandung pembuih.
Buih digunakan pada berbagai proses,
misalnya buih sabun pada pengolahan bijih logam, pada alat pemadam kebakaran,
dan lain-lain. Adakalanya buih tidak dikehendaki. Zat-zat yang dapat memecah
atau mencegah buih,antara lain eter, isoamil alkohol, dan lain-lain.
Buih mempunyai fase terdispersi gas.
Buih terdiri atas:
1. buih padat dengan medium pendispersi padat, contoh
batu apung, karet busa, dan styrofoam;
2.
buih cair atau buih dengan medium pendispersi cair,
contoh buih sabun dan putih telur.
e. Gel
Koloid yang
setengah kaku (antara padat dan cair) disebut gel. Contoh : agar-agar, lem
kanji, selai, gelatin, gel sabun, gel silika. Gel dapat terbentuk dari suatu
sol yang mengadsorbsi medium pendispersinya, sehingga terjadi koloid yang agak
padat.
3.
SIFAT-SIFAT
KOLOID
a. Efek Tyndall
Jika
seberkas cahaya dilewatkan pada suatu sistem koloid, maka cahaya tersebut akan
dihamburkannya sehingga berkas cahaya tersebut akan kelihatan. Sedangkan jika cahaya
dilewatkan pada larutan sejati maka cahaya tersebut akan diteruskannya . Sifat
koloid yang seperti inilah yang dikenal dengan efek tyndall dan sifat ini dapat
digunakan untuk membedakan koloid dengan larutan sejati. Gejala ini pertama
kali ditemukan oleh Michael Faradaykemudian diselidiki lebih lanjut oleh John
Tyndall (1820 – 1893), seorang ahli Fisikabangsa Inggris.
Efek Tyndall juga dapat menjelaskan
mengapa langit pada siang hari berwarna biru sedangkan pada saat matahari
terbenam, langit di ufuk barat berwarna jingga atau merah. Hal itu disebabkan
oleh penghamburan cahaya matahari oleh partikel koloid di angkasa dan tidak
semua frekuensi dari sinar matahari dihamburkan dengan intensitas sama.
Jika intensitas cahaya yang
dihamburkan berbanding lurus dengan frekuensi, maka pada waktu siang hari
ketika matahari melintas di atas kita frekuensi paling tinggi (warna biru) yang
banyak dihamburkan, sehingga kita melihat langit berwarna biru. Sedangkan
ketika matahari terbenam, hamburan frekuensi rendah (warna merah) lebih banyak
dihamburkan, sehingga kita melihat langit berwarna jingga atau merah.
Gejala efek tyndall yang dapat
diamati dalam kehidupan sehari-hari adalah sebagai berikut:
1. Sorot lampu mobil pada malam yang
berkabut
2. Sorot lampu proyektor dalam gedung
bioskop yang berasap dan berdebu
3. Berkas sinar matahari melalui celah
pohon-pohon pada pagi yang berkabut
b. Gerak Brown
Gerak brown
merupakan gerak patah-patah (zig-zag) partikel koloid yang terus menerus dan
hanya dapat diamati dengan mikroskop ultra. Gerak brown terjadi sebagai akibat
tumbukan yang tidak seimbang dari molekul-molekul medium terhadap partikel
koloid. Dalam suspensi tidak terjadi gerak Brown karena ukuran partikel cukup
besar, sehingga tumbukan yang dialaminya setimbang.
Partikel zat
terlarut juga mengalami gerak Brown, tetapi tidak dapat diamati. Semakin tinggi
suhu, maka gerak brown yang terjadi juga semakin cepat, karena energi molekul
medium meningkat sehingga menghasilkan tumbukan yang lebih kuat. Gerak Brown
merupakan faktor penyebab stabilnya partikel koloid dalam medium dispersinya.
Gerak brown yang terus menerus dapat mengimbangi gaya gravitasi sehingga
partikel koloid tidak mengalami sedimentasi (pengendapan).
c. Elektroforesis
Partikel
koloid dapat bergerak dalam medan listrik karena partikel koloid bermuatan
listrik. Pergerakan partikel koloid dalam medan listrik ini disebut
elektroforesis. Jika dua batang elektrode dimasukkan kedalam sistem koloid dan
kemudian dihubungkan dengan sumber arus searah, maka partikel koloid akan
bergerak kesalah satu elektrode tergantung pada jenis muatannya. Koloid
bermuatan negatif akan bergerak ke anode (elektrode positif) sedang koloid
bermuatan positif akan bergerak ke katode (elektrode negatif).
Elektroforesis dapat digunakan untuk
mendeteksi muatan partikel koloid. Jika partikel koloid berkumpul dielektrode
positif berarti koloid bermuatan negatif, jika partikel koloid berkumpul
dielektrode negatif bearti koloid bermuatan positif. Peristiwa elektroforesis
ini sering dimanfaatkan kepolisian dalam identifikasi/tes DNA pada jenazah
korban pembunuhan/ jenazah tak dikenal
d.
Adsorpsi
Adsorpsi adalah peristiwa di mana
suatu zat menempel pada permukaan zat lain, seperti ion H+ dan OH- dari medium
pendispersi. Untuk berlangsungnya adsorpsi, minimum harus ada dua macam zat,
yaitu zat yang tertarik disebut adsorbat, dan zat yang menarik disebut
adsorban. Apabila terjadi penyerapan ion ada permukaan partikel koloid maka
partikel koloid dapat bermuatan listrik yang muatannya ditentukan oleh muatan
ion-ion yang mengelilinginya.
Partikel
koloid mempunyai kemampuan menyerap ion atau muatan listrik pada permukaannya.
Oleh karena itu partikel koloid bermuatan listrik. Penyerapan pada permukaan
ini disebut dengan adsorpsi. Contohnya sol Fe(OH)3 dalam air mengadsorpsi ion
positif sehingga bermuatan positif dan sol As2S3 mengadsorpsi ion negatif
sehingga bermuatan negatif. Pemanfaatan sifat adsorpsi koloid dalam kehidupan
antara lain dalam proses pemutihan gula tebu, dalam pembuatan norit (tablet yang
terbuat dari karbon aktif) dan dalam proses penjernihan air dengan penambahan
tawas.
e. Koagulasi
Koagulasi adalah peristiwa
pengendapan atau penggumpalan koloid. Koloid distabilkan oleh muatannya. Jika
muatan koloid dilucuti atau dihilangkan, maka kestabilannya akan berkurang
sehingga dapat menyebabkan koagulasi atau penggumpalan. Pelucutan muatan koloid
dapat terjadi pada sel elektroforesis atau jika elektrolit ditambahakan ke
dalam system koloid. Apabila arus listrik dialirkan cukup lama kedalam sel
elektroforesis, maka partikel koloid akan digumpalkan ketika mencapai
electrode. Koagulasi koloid karena penambahan elektrolit terjadi karena koloid
bermuatan positif menarik ion negative dan koloid bermuatan negative menarik
ion positif. Ion-ion tersebut akan membentuk selubung lapisan kedua. Jika
selubung itu terlalu dekat, maka selubung itu akan menetralkan koloid sehingga
terjadi koagulasi.
Beberapa contoh peristiwa koagulasi
dalam kehidupan sehari-hari adalah:
1. Pembentukan
delta di muara sungai karena koloid tanah liat dalam air sungai mengalami
koagulasi ketika bercampur dengan elektrolit dalam air laut.
2. Karet dalam
latek digumpalkan dengan menambahkan asam formiat
3. Lumpur
koloidal dalam air sungai dapat digumpalkan dengan menambahkan tawas
4. Asap atau
debu pabrik dapat digumpalkan dengan alat koagulasi listrik dari cottrel.
f.
Koloid Pelindung
Ada koloid yang bersifat melindungi
koloid lain supaya tidak mengalami koagulasi. Koloid semacam ini disebut koloid
pelindung.
Koloid pelindung ini membentuk
lapisan di sekeliling partikel koloid yang lain sehingga melindungi muatan
koloid tersebut. Koloid pelindung ini akan membungkus partikel zat terdispersi,
sehingga tidak dapat lagi mengelompok.
Contoh pemanfaatan koloid pelindung adalah sebagai berikut:
1.
Pada pembuatan es krim digunakan gelatin untuk
mencegah pembentukan Kristal besar atau gula
2.
Cat dan tinta dapat bertahan lama karena menggunakan
suatu koloid pelindung.
3.
Zat-zat pengemulsi seperti sabun dan detergen juga
tergolong koloid pelindung.
g.
Dialisis
Untuk stabilitas koloid diperlukan
sejumlah muatanion suatu elektrolit. Akan tetapi, jika penambahan elektrolit ke
dalam sistem koloid terlalu banyak, kelebihan ini dapat mengendapkan fase
terdispersi dari koloid itu. Hal ini akan mengganggu stabilitas sistem koloid
tersebut. Untuk mencegah kelebihan elektrolit, penambahan elektrolit dilakukan
dengan cara dialisis.
Dialisis merupakan proses pemurnian
koloid dengan membersihkan atau menghilangkan ion-ion pengganggu menggunakan
suatu kantong yang terbuat dari selaput semipermiabel. Caranya, sistem koloid
dimasukkan ke dalam kantong semipermeabel, dan diletakkan dalam air. Selaput
semipermeabel ini hanya dapat dilalui oleh ion-ion, sedang partikel koloid
tidak dapat melaluinya, dengan demikian akan diperoleh koloid yang murni.
Ion-ion yang keluar melalui selaput
semipermeabel ini kemudian larut dalam air. Dalam proses dialisis hilangnya
ion-ion dari sistem koloid dapat dipercepat dengan menggunakan air yang
mengalir. Peristiwa dialisis ini diaplikasikan dalam proses pencucian darah di
dunia kedokteran.
4.
KOLOID
LIOFIL DAN LIOFOB
Koloid yang
memiliki medium dispersi cair dibedakan atas koloid liofil dan koloid liofob.
Suatu koloid disebut koloid liofil apabila terdapat gaya tarik-menarik yang
cukup besar antara zat terdispersi dengan mediumnya. Liofil berarti suka cairan
(Yunani: lio = cairan, philia = suka). Sebaliknya, suatu koloid disebut koloid
liofob jika gaya tarik-menarik tersebut tidak ada atau sangat lemah. Liofob
berarti tidak suka cairan (Yunani: lio = cairan, phobia = takut atau benci).
Jika medium dispersi yang dipakai adalah air, maka kedua jenis koloid di atas
masing-masing disebut koloid hidrofil dan koloid hidrofob.
Contoh:
1.
Koloid hidrofil: sabun, detergen, agar-agar, kanji,
dan gelatin.
2.
Koloid hidrofob: sol belerang, sol Fe(OH)3, sol-sol
sulfida, dan sol-sol logam.
Koloid
liofil/hidrofil lebih mantap dan lebih kental daripada koloid liofob/ hidrofob.
Butir-butir koloid liofil/hidrofil membungkus diri dengan cairan/air mediumnya.
Hal ini disebut solvatasi/hidratasi. Dengan cara itu butir-butir koloid
tersebut terhindar dari agregasi (pengelompokan). Hal demikian tidak terjadi
pada koloid liofob/hidrofob. Koloid liofob/hidrofob mendapat kestabilan karena
mengadsorpsi ion atau muatan listrik. Sebagaimana telah dijelaskan bahwa muatan
koloid menstabilkan sistem koloid.
Sol hidrofil tidak akan menggumpal pada penambahan sedikit elektrolit. Zat
terdispersi dari sol hidrofil dapat dipisahkan dengan pengendapan atau
penguapan. Apabila zat padat tersebut dicampurkan kembali dengan air, maka
dapat membentuk kembali sol hidrofil. Dengan perkataan lain, sol hidrofil
bersifat reversibel. Sebaliknya, sol hidrofob dapat mengalami koagulasi pada
penambahan sedikit elektrolit. Sekali zat terdispersi telah dipisahkan, tidak
akan membentuk sol lagi jika dicampur kembali dengan air. Perbedaan sol
hidrofil dengan sol hidrofob disimpulkan sebagai berikut.
5.
Peranan Koloid dalam Kehidupan Sehari-hari
a.
Mengurangi polusi udara
Gas buangan pabrik yang mengandung
asap dan partikel berbahaya dapat diatasi dengan menggunakan alat yang disebut
pengendap cottrel. Prinsip kerja alat ini memanfaatkan sifat muatan dan
penggumpalan koloid sehingga gas yang dikeluarkan ke udara telah bebas dari
asap dan partikel berbahaya
Asap dari
pabrik sebelum meninggalkan cerobong asap dialirkan melalui ujung-ujung logam
yang tajam dan bermuatan pada tegangan tinggi (20.000 sampai 75.000 volt).
Ujung-ujung yang runcing akan mengionkan molekul-molekul dalam udara. Ion-ion
tersebut akan diadsorpsi oleh partikel asap dan menjadi bermuatan. Selanjutnya,
partikel bermuatan itu akan tertarik dan diikat pada elektrode yang lainnya.
Pengendap Cottrel ini banyak digunakan dalam industri untuk dua tujuan, yaitu
mencegah polusi udara oleh buangan beracun dan memperoleh kembali debu yang
berharga (misalnya debu logam).
b. Penggumpalan
lateks
Getah karet
dihasilkan dari pohon karet atau hevea. Getah karet merupakan sol, yaitu
dispersi koloid fase padat dalam cairan. Karet alam merupakan zat padat yang
molekulnya sangat besar (polimer). Partikel karet alam terdispersi sebagai
partikel koloid dalam sol getah karet. Untuk mendapatkan karetnya, getah karet
harus dikoagulasikan agar karet menggumpal dan terpisah dari medium
pendispersinya. Untuk mengkoagulasikan getah karet, biasanya digunakan asam
formiat; HCOOH atau asam asetat; CH3COOH. Larutan asam pekat itu akan merusak
lapisan pelindung yang mengelilingi partikel karet. Sedangkan ion-ion H+-nya
akan menetralkan muatan partikel karet sehingga karet akan menggumpal.
Selanjutnya,
gumpalan karet digiling dan dicuci lalu diproses lebih lanjut sebagai lembaran
yang disebut sheet atau diolah menjadi karet remah (crumb rubber). Untuk
keperluan lain, misalnya pembuatan balon dan karet busa, getah karet tidak
digumpalkan melainkan dibiarkan dalam wujud cair yang disebut lateks. Untuk
menjaga kestabilan sol lateks, getah karet dicampur dengan larutan amonia; NH3.
Larutan amonia yang bersifat basa melindungi partikel karet di dalam sol lateks
dari zat-zat yang bersifat asam sehingga sol
tidak menggumpal.
c. Membantu
pasien gagal ginjal
Proses
dialisis untuk memisahkan partikel-partikel koloid dan zat terlarut merupakan
dasar bagi pengembangan dialisator. Penerapan dalam kesehatan adalah sebagai
mesin pencuci darah untuk penderita gagal ginjal. Ion-ion dan molekul kecil
dapat melewati selaput semipermiabel dengan demikian pada akhir proses pada
kantung hanya tersisa koloid saja. Dengan melakukan cuci darah yang
memanfaatkan prinsip dialisis koloid, senyawa beracun seperti urea dan keratin
dalam darah penderita gagal ginjal dapat dikeluarkan. Darah yang telah bersih
kemudian dimasukkan kembali ke tubuh pasien.
d. Penjernihan air
Untuk
memperoleh air bersih perlu dilakukan upaya penjernihan air. Kadang-kadang air
dari mata air seperti sumur gali dan sumur bor tidak dapat dipakai sebagai air
bersih jika tercemari. Air permukaan perlu dijernihkan sebelum dipakai. Upaya
penjernihan air dapat dilakukan baik skala kecil (rumah tangga) maupun skala
besar seperti yang dilakukan oleh Perusahaan Daerah Air Minum (PDAM). Pada
dasarnya penjernihan air itu dilakukan secara bertahap. Mula-mula mengendapkan
atau menyaring bahan-bahan yang tidak larut dengan saringan pasir. Kemudian air
yang telah disaring ditambah zat kimia, misalnya tawas atau aluminium sulfat
dan kapur agar kotoran menggumpal dan selanjutnya mengendap, dan kaporit atau
kapur klor untuk membasmi bibit-bibit penyakit. Air yang dihasilkan dari
penjernihan itu, apabila akan dipakai sebagai air minum, harus dimasak terlebih
dahulu sampai mendidih beberapa saat lamanya.
Untuk
memperjelas tentang penjernihan air perhatikan gambar 9.13 berikut!
Proses
pengolahan air tergantung pada mutu baku air (air belum diolah), namun pada
dasarnya melalui 4 tahap pengolahan. Tahap pertama adalah pengendapan, yaitu
air baku dialirkan perlahan-lahan sampai benda-benda yang tak larut mengendap.
Pengendapan ini memerlukan tempat yang luas dan waktu yang lama. Benda-benda
yang berupa koloid tidak dapat diendapkan dengan cara itu.
Pada tahap
kedua, setelah suspensi kasar terendapkan, air yang mengandung koloid diberi
zat yang dinamakan koagulan. Koagulan yang banyak digunakan adalah aluminium
sulfat, besi(II)sulfat, besi(III)klorida, dan klorinasi koperos
(FeCl2Fe2(SO4)3). Pemberian koagulan selain untuk mengendapkan
partikel-partikel koloid, juga untuk menjadikan pH air sekitar 7 (netral). Jika
pH air berkisar antara 5,5–6,8, maka yang digunakan adalah aluminium sulfat,
sedangkan untuk senyawa besi sulfat dapat digunakan pada pH air 3,5–5,5.
Pada tahap
ketiga, air yang telah diberi koagulan mengalami proses pengendapan,
benda-benda koloid yang telah menggumpal dibiarkan mengendap. Setelah mengalami
pengendapan, air tersebut disaring melalui penyaring pasir sehingga sisa
endapan yang masih terbawa di dalam air akan tertahan pada saringan pasir
tersebut.
Pada tahap
terakhir, air jernih yang dihasilkan diberi sedikit air kapur untuk menaikkan
pHnya, dan untuk membunuh bakteri diberikan kalsium hipoklorit (kaporit) atau
klorin (Cl2).
e. Sebagai
deodoran
Deodoran mengandung aluminium
klorida yang dapat mengkoagulasi atau mengendapkan protein dalam
keringat.endapan protein ini dapat menghalangi kerja kelenjer keringat sehingga
keringat dan potein yang dihasilkan berkurang.
f.
Sebagai bahan makanan dan obat
Ada zat-zat yang tidak larut dalam
air sehingga harus dikemas dalam bentuk koloid sehingga mudah diminum.
Contohnya obat dalam bentuk kapsul.
g.
Sebagai bahan kosmetik
Ada berbagai bahan kosmetik kosmetik
berupa padatan, tetapi lebih baik digunakan dalam bentuk cairan. Untuk itu
biasanya dibuat berupa koloid dengan tertentu.
h.
Sebagai bahan pencuci
Prinsip koloid juga digunakan dalam proses
pencucian dengan sabun dan detergen. Dalam pencucian dengan sabun atau
detergen, sabun/ detergen berfungsi sebagai emulgator. Sabun/detergen akan
mengemulsikan minyak dalam air sehingga kotoran-kotoran berupa lemak atau
minyak dapat dihilangkan dengan cara pembilasan dengan air.
6.
PEMBUATAN
KOLOID
a. Cara
kondensasi
Dengan cara
kondensasi partikel larutan sejati bergabung menjadi partikel koloid. Cara ini
dapat dilakukan melalui reaksi-reaksi kimia seperti reaksi redoks, hidrolisis,
dekomposisi rangkap, atau dengan pergantian pelarut.
1) Reaksi
subtitusi
Misalnya
larutan natrium tiosulfat direaksikan dengan larutan asam klorida , maka akan
terbentuk belerang. Partikel belerang akan bergabung menjadi semakin besar
sampai berukuran koloid sehingga terbentuk sel belerang. Seperti reaksi
Na2SO3(aq) +
2HCl(aq) →2 NaCl(aq)+ H2O(l) + S(s)
2) Reaksi
Hidrolisis
Reaksi
hidrolisis adalah reaksi suatu zat dengan air. Sol Fe(OH)3 dibuat melalui
hidrolisis larutan FeCl3, yaitu dengan memanaskan larutan FeCl3. Hidrolisis
larutan AlCl3 akan menghasilkan koloid Al(OH)3. Reaksinya adalah:
FeCl3(aq) +
3H2O(l) → Fe(OH)3(s) +3HCl(aq)
AlCl3(aq) +
3 H2O(l) → Al(OH)3(s) + 3HCl(aq)
3) Reaksi
Redoks
Reaksi redoks adalah reaksi yang disertai perubahan
bilangan oksidasi. Pembuatan sol belerang dari reaksi antara hidrogen sulfida
(H2S) dengan belerang dioksida (SO2), yaitu dengan mengalirkan gas H2S kedalam
larutan SO2
2H2S(g) + SO2(aq) → 2H2O(l) + 3S (s)
4)
Reaksi Dekomposisi Rangkap
Contohnya adalah pembuatan sol As2S3 dengan mereaksikan
larutan H3AsO3 dengan larutan H2S. Reaksinya adalah sebagai berikut:
2H3AsO3(aq) + 3H2S(aq) → As2S3(s) + 6H2O(l)
5)
Penggantian Pelarut
Cara ini dilakukan dengan menggnti medium pendispersi
sehingga fase terdispersi yang semula larut menjadi berukuran koloid. Misalnya
larutan jenuh kalsium asetat jika dicampur dengan alcohol akan terbentuk suatu
koloid berupa gel.
b.
Cara dispersi
Dengan cara dispersi partikel kasar
dipecah menjadi partikel koloid. Cara dispersi dapat dilakukan secara mekanik,
peptisasi, atu dengan loncatan bunga listrik(busur bredig).
1.
Cara mekanik
Dengan cara ini, butir-butir kasar digerus dengan lumpang, sampai diperoleh
tingkat kehalusan tertentu, kemudian diaduk dengan medium pendispersi. Contoh
pembuatan sol belerang dengan menggerus serbuk belerang bersama zat inert
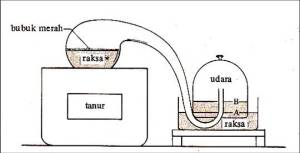
seperti gula pasir, kemudian mencampur dengan air.
2.
Cara peptisasi
Cara peptisasi adalah pembuatan koloid dari butir-butir kasar atau dari
suatu endapan dengan bantuan zat pemecah (pemeptisasi).
3.
Cara busur bredig
Cara busur bredig digunakan untuk membuat sol-sol logam. Logam yang akan
dijadikan koloid digunakan sebagai elktrode yang dicelupkan kedalam medium
dispersi, kemudian diberi loncatan listrik dikedua ujungnya. Mula-mula atom
logam akan terlempar kedalam air, lalu atom tersebut mengalami kondensasi
sehingga membentuk partikel koloid. Jadi cara busur bredig ini merupakan
gabungan cara disperse dan kondensasi.